慢性持续性高危型HPV感染
由于妇女宫颈癌的发病率和死亡率远较其他HPV相关恶性肿瘤高,因此HPV人群感染率的研究都是在女性中进行的.结果显示,性活跃期妇女HPV感染率很高,约占50%~80%,其中50%为高危型HPV感染.HPV感染无任何临床症状,而且约50%~90%的HPV感染可在感染后的数月至2年内被免疫系统清除,感染的平均持续时间为8~12个月,其中低危型HPV感染的平均清除时间为5~6个月,高危型HPV为8~14个月,而且HPV-16或-18的持续感染时间比其他型别更长.如果在间隔一年以上的时间连续两次检测出同一高危型的HPV DNA被认为是持续性感染.只有慢性持续性高危型HPV感染,才能较终演变为宫颈癌.慢性持续性感染的易感因子包括免疫抑制、慢性炎症和某些HLA基因型等,如HIV感染患者或器官移植病人及宫颈HSV-2及沙眼衣原体CT感染患者中,宫颈HPV感染率、宫颈鳞状上皮内病变、宫颈癌及肛门癌的发病率均明显增高.另外,其他促癌因素还包括机体营养状况及宫颈局部环境因素.特别值得注意的是,几乎所有高危型别HPV即使病毒拷贝数很低时仍有恶性转化能力,因此这一特点与其他人类致病病毒显著不同.
早在19世纪人们就发现妓女的宫颈癌发病率较高,20世纪通过对宫颈癌风险因素的流行病学研究,1972年zur Hausen首先提出宫颈癌可能由HPV感染引起,其所在的实验室于1977~1984年从生殖道疣中克隆到HPV-6、-11、-16和-18.1976年,Meisels和Fortin提出,宫颈分泌物中的凹空的角化细胞(koilocyte)是由感染HPV所致,并指出良性的疣状病变不会进展为宫颈癌,而宫颈上皮中度不典型病变可发展为宫颈癌.这些观点后来都得到了证实.zur Hausen等在1981年完成的HPV与宫颈癌关系的流行病学研究,认为HPV可能在宫颈癌的发病中起重要作用.他们的结论得到体外实验研究的支持.中国医学科学院基础医学研究所李昆\司静懿等领导的研究组自1984年开始,与中国预防医学科学院病毒学研究所的曾毅院士及德国海德堡肿瘤研究所的zur Hausen教授合作,开展对我国宫颈癌的流行病学研究,建立了多重引物PCR法,对中国华北、东北、新疆、贵州、陕西等地区的大规模妇女宫颈癌患者的标本检测发现:HPV-16是诱发我国妇女宫颈癌主要病毒型别,在宫颈癌中阳性率高达60.4%,首先报道了中国妇女宫颈癌的发生与高危型HPV感染相关的文章[1].随后又证实了高危型HPV-E6及E7蛋白是病毒主要转化蛋白,其转化活性主要表现在E6或E7单独作用均可诱导NIH3T3等可传代细胞系在软琼脂上形成集落并生长,E7单独诱导啮齿类动物原代细胞出现永生化,协同Hi-ras及fos可完全转化原代啮齿细胞,E6/E7协同作用可增加永生化啮齿类原代细胞的效率,并可诱导人原代上皮细胞永生化(并建立了永生化的人宫颈上皮细胞系),若再辅以HSV或HCMV协同,可使永生化细胞出现恶性变.封闭HPV感染阳性肿瘤细胞中E6和E7的表达,可使瘤细胞的恶性表型向良性逆转.20世纪80~90年代的大量基础研究结果不仅基本揭示病毒癌基因的功能及HPV致癌机制,同时在HPV的生活周期及预防性疫苗的研究方面都取得了实质性的进展.这些研究结果从不同的角度上都证实了持续性高危型HPV感染是宫颈癌发生的主要诱因.
HPV感染细胞及低级鳞状上皮内病变细胞中病毒常成游离状态,随着细胞异型程度的加重,高危型病毒基因组常发生断裂,诱发病毒序列整合到宿主基因组中,整合发生时,E1、E2、E5及大部分的壳蛋白基因序列断裂丢失,而E6和E7基因及其上游的LCR总是被选择性保留.E2在产毒性感染阶段可抑制E6和E7的表达,病毒基因的整合使这种抑制活性得以解除,导致E6和E7的高水平表达,外壳蛋白的表达缺失或仅部分低水平的表达.另外,如果细胞基因组中的启动子处于整合位点附近,也有可能促进病毒癌基因的高水平表达.与HPV感染细胞相比,感染相关的高级的鳞状上皮内病变及恶性肿瘤中E6和E7蛋白的表达水平显著提高,表明E6及E7蛋白的表达水平与病变的进展程度及细胞的恶性转化密切相关.HPV-18及-16阳性的肿瘤细胞系及宫颈癌细胞中病毒基因序列整合形式存在的比例很高,仅少量病毒基因组DNA呈游离的形式存在,E6及E7癌蛋白呈高水平表达[2].与诱发细胞恶性转变密切相关的较重要生物学事件是E6和E7癌蛋白对细胞内肿瘤抑癌基因的灭活.高危型HPV E7蛋白与细胞周期负调控蛋白pRB结合并灭活其功能.E7蛋白可与E2F生长因子竞争性的结合pRB,导致E2F释放,诱发细胞从G1期到S期转换.高危型HPV E6蛋白通过E6-AP(E6 associated protein,E6-AP)的介导,促使p53蛋白进入泛素依赖的降解途径,利于感染细胞克服因遗传物质损伤引发的细胞周期停止的压力.研究发现端粒酶的激活与宫颈异型增生和宫颈癌的进展过程有关.E6还可活化端粒酶,抑制细胞凋亡.E5虽然一般在病毒整合时丢失,但仍有少量病毒基因组以染色体外的游离体存在,可表达E5蛋白,进而促进EGF-R家族成员蛋白和ErbB4蛋白的高水平表达,传递促进细胞增殖信号,参与感染细胞的恶性进展.上述因素在不同的阶段协同作用,使HPV感染细胞处于不断的细胞周期中,进而利于病毒基因组的复制和繁殖,并使含有整合状态的病毒癌基因的细胞不断的增殖,为病毒整合基因创造在宿主细胞内“繁殖”的机会,在宿主因素及其他多种促癌因素的协同作用下,使感染细胞基因变异不断累积,较终使感染细胞走上了不归路——发生恶性转化.低危型和高危型HPV的早期蛋白在生化和生物学上有很多不同的特性.如HPV-6/-11 E7蛋白与Rb结合效率较高危型HPV-16/-18低10倍,而且低危型HPV的E7蛋白在细胞转化和被CKII磷酸化的效率上也明显低于高危型HPV.因此低危型HPV的早期蛋白不具恶性转化活性.
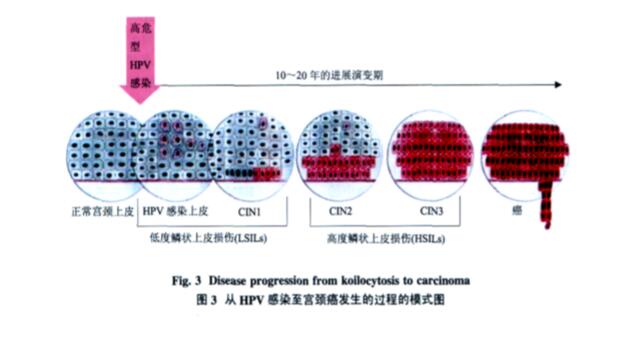
宫颈异型增生一般好发于宫颈与柱状上皮的移型区附近及外周区,恶性转化细胞总是发生在宫颈移行区的鳞状上皮.从慢性持续性高危型HPV感染到较后进展为恶性肿瘤常需要10~20年的时间,但少数病例例外,1~2年内即可进展为恶性肿瘤.根据感染组织的病理学特征,将从持续性病毒感染到恶性转变整个过程分为4个阶段,如图3所示.
阶段1:宫颈上皮内增生1级(cervical intraepithelial neoplasia,CIN/1),细胞异型增生较轻,仅累及上皮基部的细胞,又称低级鳞状上皮内病变(low squamous intraepithelial lesions,LSIL).LSIL病变可由低危型或高危型HPV感染引起,可伴有多种HPV型别共同感染,病毒DNA常以游离形式存在,E6和E7表达水平较低,表达病毒衣壳蛋白,并可释放病毒颗粒.绝大多数CIN1可自愈,仅少数进展为中重度异性增生性病变,甚至恶性肿瘤.
阶段2:宫颈上皮内增生2级(CIN/2),细胞中度异型增生,表层细胞仅部分为形态相对正常的细胞,属高级鳞状上皮内病变(high squamous intraepithelial lesions,HSIL).
阶段3:宫颈上皮内增生3级(CIN/3),该阶段病变上皮的全层均为重度异型性增生细胞,属HSIL,也包括可能突破基底膜的原位癌
阶段4:此阶段异型病变的细胞突破基底膜,侵入皮下及深层组织,又称侵袭性癌阶段.
高级鳞状上皮内病变,又称癌前病变,在癌前病变或癌症中,病毒DNA常整合进宿主细胞,且随着病变程度的加重,整合的比例增高,恶性转化后,病毒序列则主要是以整合形式存在,特别是在HPV-16阳性的肿瘤细胞中.
宫颈癌是危及全球妇女健康的重要疾病,发病率仅次于乳腺癌,高居妇科恶性肿瘤的第二位,每年全世界约有50万新发病例,25万死亡病例,其中发展中国家占2/3.我国是宫颈癌的高发区,占全球宫颈癌总数的10%.分子流行病学研究发现约99.7%以上的宫颈癌标本HPV阳性.国际癌症研究组织(IARC)对世界25个国家(不包括东亚地区)的3 607例宫颈癌标本的研究发现了15种高危型HPV,按照在宫颈癌组织中检出的阳性率由高至底依次为HPV-16(53.5%)、-18(17.2%)、-45(6.7%)、-31(2.9%)、-33(2.6%)、-52(2.3%)、-58(2.2%)、-35(1.4%)、-59(1.3%)、-56(1.2%)、-51(1.0%)、-39(0.7%)、-68(0.6%)、-73(0.5%)和-82(0.3%).而与我国宫颈癌密切相关主要病毒类型依次为HPV-16、-58和-18,HPV-58是我国、日本、朝鲜等东亚地区高发病毒流行株.对源自我国北京、长沙、香港、江西、上海、四川和西安的1 555例中国妇女ICC组织中HPV的分子流行病学分析显示,高危型HPV的检出率为82.5%,其中以HPV-16较为常见,占60.2%,其次为HPV-18(8.2%)、-58(6.1%)、-52(2.8%)、-33(2.2%)、-31(1.2%)、-6(0.8%)、-59(0.7%)、-45(0.6%)和-35(0.2%)[3].
荐 相关文章
 手机端查看更多优质内容
手机端查看更多优质内容